Με αφορμή πληθώρα δημοσιευμάτων από πολλές και ποικίλες πηγές σχετικά με τη χρήση ενέσιμων αντιδιαβητικών φαρμάκων για τη διαχείριση του σωματικού βάρους, ο ΕΟΦ κρίνει σκόπιμο να ενημερώσει υπεύθυνα τους επαγγελματίες υγείας και το κοινό για τα εξής:
Tα αντιδιαβητικά φάρμακα δεν έχουν μελετηθεί και δεν προορίζονται για χρήση για αισθητικούς σκοπούς, δηλαδή για απώλεια βάρους από υγιείς ανθρώπους.
Τα αντιδιαβητικά φάρμακα που έχουν ως εγκεκριμένη ένδειξη τη διαχείριση βάρους προορίζονται για την επιπρόσθετη αγωγή παχύσαρκων ασθενών (ΒΜ≥30) ή υπέρβαρων ασθενών (ΒΜΙ≥27) εφόσον φιλοξενούν μια τουλάχιστον επιπλέον διαταραχή που σχετίζεται με το αυξημένο βάρος (π.χ. υπέρταση, δυσλιπιδαιμία, αποφρακτική, υπνική άπνοια, καρδιαγγειακή νόσος, κ.α.) και οι οποίοι δεν έχουν ανταποκριθεί ικανοποιητικά στην ούτως ή άλλως επιβεβλημένη δίαιτα χαμηλών θερμίδων και αυξημένη σωματική δραστηριότητα.
Τα αντιδιαβητικά φάρμακα που δεν έχουν ως εγκεκριμένη ένδειξη τη διαχείριση βάρους σε νοσογόνες καταστάσεις δεν έχουν μελετηθεί και δεν προορίζονται για τον σκοπό αυτό.
Ο ΕΟΦ τονίζει ότι «όλα τα αντιδιαβητικά φάρμακα είναι συνταγογραφούμενα και ως εκ τούτου απαγορεύεται η διαφήμιση/προώθηση προς το κοινό με κάθε τρόπο. Σύμφωνα με τη νομοθεσία, προβλέπεται μόνο η ιατρική ενημέρωση από τους ιατρικούς επισκέπτες προς τους επαγγελματίες υγείας που συνταγογραφούν το φάρμακο μετά από διάγνωση και μόνο, ενώ όλες οι προωθητικές ενέργειες/προωθητικά υλικά των εταιρειών υπόκεινται σε έλεγχο του ΕΟΦ. Ο ΕΟΦ παρακολουθεί τις σχετικές αναφορές στον Τύπο και στα Μέσα Κοινωνικής Δικτύωσης και προβαίνει σε επιβολή των προβλεπόμενων κυρώσεων».
Ο ΕΟΦ καλεί το κοινό και τους επαγγελματίες της υγείας να μη χρησιμοποιούν ως πηγές ενημέρωσης σχετικά δημοσιεύματα, τα οποία προωθούν τη χρήση των φαρμάκων είτε ως καταναλωτικά προϊόντα για αισθητικούς σκοπούς, είτε ως πολλά υποσχόμενη λύση έναντι πολυάριθμων προβλημάτων υγείας, εκτός των εγκεκριμένων ενδείξεων.
Όλες οι έγκυρες πληροφορίες σχετικά με την ορθή χρήση κάθε φαρμάκου, αποτελούν μέρος της Άδειας Κυκλοφορίας του και είναι δημόσιες και πλήρως προσβάσιμες μέσω της ιστοσελίδας του Ευρωπαϊκού Οργανισμού Φαρμάκων (ΕΜΑ-εφόσον πρόκειται για κεντρικές ΑΚ). Επισημαίνεται ότι οι πληροφορίες αυτές είναι πάντοτε επικαιροποιημένες με τα πλέον πρόσφατα αξιολογημένα δεδομένα ασφάλειας και αποτελεσματικότητας, και ως εκ τούτου αποτελούν την πλέον αξιόπιστη πηγή πληροφόρησης τόσο για επαγγελματίες της υγείας (Περίληψη Χαρακτηριστικών Προϊόντος, Σχέδιο Διαχείρισης Κινδύνου κ.λπ.) όσο και για το κοινό(Φύλλο Οδηγιών Χρήστη).
«Επί του παρόντος, στην ευρύτερη κατηγορία των ενέσιμων αντιδιαβητικών φαρμάκων, εκτός ινσουλίνης, έχουν λάβει Άδεια Κυκλοφορίας από τον Ευρωπαϊκό Οργανισμό Φαρμάκων ΕΜΑ τα ακόλουθα φάρμακα (δραστικές ουσίες):
LYXUMIA (λιξισενατίδη), VICTOZA (λιραγλουτίδη), SAXENDA (λιραγλουτίδη), TRULICITY (ντουλαγλουτίδη) OZEMPIC (σεμαγλουτίδη), WEGOVY (σεμαγλουτίδη), MOUNJARO (τιρζεπατίδη) που διαφοροποιούνται στις εγκεκριμένες ενδείξεις ως εξής:
OZEMPIC, LYXUMIA, TRULICITY & VICTOZA: ενδείκνυνται για την αγωγή ενηλίκων με σακχαρώδη διαβήτη τύπου 2
WEGOVY και SAXENDA: ενδείκνυνται ως πρόσθετη αγωγή ενηλίκων σε δίαιτα χαμηλών θερμίδων και αυξημένη σωματική δραστηριότητα για τη διαχείριση βάρους σε παχύσαρκους ασθενείς (ΒΜΙ ≥30) ή σε υπέρβαρους (BMI≥ 27) εφόσον φιλοξενούν μια τουλάχιστον επιπλέον διαταραχή που σχετίζεται με το αυξημένο βάρος (π.χ. υπέρταση, δυσλιπιδαιμία, αποφρακτική, υπνική άπνοια, καρδιαγγειακή νόσος, κ.α.), καθώς επίσης ως πρόσθετη αγωγή παχύσαρκων εφήβων άνω των 12 ετών με BMI που αντιστοιχεί σε ≥30 kg/m2 των ενηλίκων και βάρος μεγαλύτερο των 60 kg.
MOUNJARO: έχει λάβει και τις δύο παραπάνω ενδείξεις στους ενήλικες
Σύμφωνα με την αξιολόγηση των δεδομένων που έχουν προκύψει από τις κλινικές δοκιμές και την κυκλοφορία των ανωτέρω φαρμάκων, η χρήση τους συνοδεύεται μεταξύ άλλων από ανεπιθύμητες ενέργειες του γαστρεντερικού, που εκδηλώνονται συχνά/πολύ συχνά (ναυτία, έμετος, διάρροια/δυσκοιλιότητα, δυσπεψία, γαστρίτιδα, γαστροοισοφαγική παλινδρόμηση κ.λπ.) ή σπανιότερα (παγκρεατίτιδα/οξεία παγκρεατίτιδα ή/και χολολιθίαση/χολοκυστίτιδα). Επιπλέον, δεν έχει, σύμφωνα με το ΑΠΕ-ΜΠΕ, ακόμα αποκλειστεί ενδεχόμενη συσχέτιση χρήσης των φαρμάκων με κίνδυνο ανάπτυξης κακοήθειας θυρεοειδούς και παγκρέατος, όπως προκύπτει από τα Σχέδια Διαχείρισης Κινδύνου των προϊόντων. Το προφίλ ασφάλειας καλεί για ιδιαίτερη προσοχή στην εξέταση του ενδεχόμενου χορήγησης των φαρμάκων της κατηγορίας για διαχείριση βάρους σε εφήβους. Κατά συνέπεια, η συνταγογράφηση είναι σημαντικό να περιορίζεται στις εγκεκριμένες ενδείξεις, κατόπιν αξιολόγησης των δυνητικών παραγόντων κινδύνου κάθε ασθενούς και συνεκτίμησης των διαθέσιμων εναλλακτικών, ώστε να επιδιώκεται το βέλτιστο θεραπευτικό αποτέλεσμα, ελαχιστοποιώντας κατά το δυνατό την πιθανότητα αρνητικής επίπτωσης στο εγγύς ή απώτερο μέλλον».
Ο ΕΟΦ υπενθυμίζει ότι η ορθή χρήση των φαρμάκων αποτελεί προϋπόθεση για τη μέγιστη δυνατή ασφάλεια και επάρκεια και καλεί τους επαγγελματίες υγείας και το κοινό να εμπιστεύονται έγκυρες πηγές για την ενημέρωσή τους, προκειμένου να καταλήξουν στις πλέον ενδεδειγμένες, αυστηρά εξατομικευμένες θεραπευτικές επιλογές.
Ο ΕΟΦ με απόφασή του κάνει γνωστή την ανάκληση παρτίδας του φαρμακευτικού προϊόντος HELICOBACTER TEST INFAI
Συγκεκριμένα στην απόφαση αναφέρεται «Την ανάκληση της παρτίδας UR24E23A1 (ημερ.λήξης 05/2026) του φαρμακευτικού προϊόντος ΄΄HELICOBACTER TEST INFAI (13C UREA) PD.ORA.SOL 45MG/JAR΄΄ λόγω σφάλματος στη δήλωση κωδικού προϊόντος κατά τη διαδικασία της δήλωσης επικόλλησης της ταινίας γνησιότητας.
Η παρούσα Απόφαση εκδίδεται με σκοπό την ενίσχυση της εθελοντικής ανάκλησης της εταιρείας Fertithera Labs Φαρμακευτική.
Η Fertithera Labs Φαρμακευτική, ως Τοπικός Αντιπρόσωπος, οφείλει να επικοινωνήσει άμεσα με τους αποδέκτες του προϊόντος και να αποσύρει την εν λόγω παρτίδα από την αγορά μέσα σε εύλογο χρονικό διάστημα.
Τα σχετικά παραστατικά τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Φάρμακα: Πώς θα αντιμετωπιστούν οι ελλείψεις – Τι λένε ο ΕΟΦ και ο Πανελλήνιος Φαρμακευτικός Σύλλογος
06 Ιουλ 2023Σε τέσσερα μέτρα για να αντιμετωπιστούν οι ελλείψεις φαρμάκων που υπάρχουν στην ελληνική αγορά εστιάζουν το υπουργείο Υγείας και ο Εθνικός Οργανισμός Φαρμάκων (ΕΟΦ).
Ο ΕΟΦ εξηγεί ότι ως έλλειψη θεωρείται η αδυναμία κάλυψης των αναγκών σε επίπεδο δραστικής ουσίας και όχι σκευάσματος, καθώς η ουσία μπορεί να παρέχεται μέσω εναλλακτικών γενοσήμων σκευασμάτων. Στις περιπτώσεις όπου υπάρχουν εναλλακτικά σκευάσματα ενθαρρύνεται η κάλυψη των αναγκών με γενόσημα φάρμακα.
Τα τέσσερα μέτρα
Η απαγόρευση των εξαγωγών, αναφέρει ο ΕΟΦ, αποτελεί μέτρο το οποίο εφαρμόζεται προσωρινά και επιλεγμένα με στόχο τη διασφάλιση των αναγκών των ασθενών με φάρμακα τα οποία εξάγονται σε άλλες χώρες και ως εκ τούτου καθίστανται ελλειπτικά ή δυσεύρετα για τον Έλληνα ασθενή.
Σύμφωνα με τον Οργανισμό «αποφασίστηκε οι φαρμακευτικές εταιρείες να αυξήσουν σημαντικά το επόμενο χρονικό διάστημα τις ποσότητες των φαρμάκων που κυκλοφορούν στην Ελληνική αγορά, το οποίο άλλωστε αποτελεί και υποχρέωσή τους».
Οι φαρμακαποθήκες υποχρεώνονται να δηλώνουν τις πωλήσεις και τα αποθέματά τους για τα ελλειπτικά φάρμακα σε πραγματικό χρόνο, ώστε να είναι άμεσα διαθέσιμη η εκτίμηση του φαινομένου και η ανεύρευση λύσεων. Για το λόγο αυτό, τονίζει ο ΕΟΦ, αναπτύχθηκε ειδική πλατφόρμα η οποία θα τεθεί σε λειτουργία μέσα στην εβδομάδα.
Τέλος, με απόφαση του υπουργείου Υγείας η χορήγηση φαρμάκων που βρίσκονται σε έλλειψη ή περιορισμένη διάθεση θα γίνεται από τα φαρμακεία στους ασθενείς μόνο εφόσον αυτά έχουν συνταγογραφηθεί ηλεκτρονικά βάσει των ενδείξεων και από τις ιατρικές ειδικότητες που προβλέπονται.
Οποιαδήποτε έλλειψη ή δυσκολία ανεύρεσης φαρμάκου πρέπει να δηλώνεται από τους φαρμακοποιούς και τους ιατρούς στην πλατφόρμα του ΕΟΦ, ώστε να λαμβάνεται μέριμνα άμεσα.
ΠΦΣ: Για τις ελλείψεις φαρμάκων απαιτείται η αποτελεσματική λειτουργία των μηχανισμών ελέγχου
Ο Πανελλήνιος Φαρμακευτικός Σύλλογος (ΠΦΣ) τονίζει ότι είναι προς τη σωστή κατεύθυνση τα μέτρα που ανακοίνωσε ο Εθνικός Οργανισμός Φαρμάκων (ΕΟΦ) για την αντιμετώπιση των ελλείψεων φαρμάκων στην ελληνική αγορά, «αρκεί να εφαρμόζονται, καθόσον, όπως όλοι γνωρίζουμε, στο ελληνικό Δημόσιο, ενώ υπάρχει σχετική νομοθεσία, η οποία μάλιστα είναι και πολύ αυστηρή, δεν εφαρμόζεται για όλους τους κρίκους της εφοδιαστικής αλυσίδας διακίνησης του φαρμάκου».
Από τις ανακοινώσεις του ΕΟΦ, αναφέρει ο ΠΦΣ, προκύπτει η αναγκαιότητα, προκειμένου να λειτουργήσει η δυνατότητα αντικατάστασης ενός γενοσήμου φαρμάκου όταν αυτό είναι ελλειπτικό, να μην παρέχεται από το σύστημα της Ηλεκτρονικής Συνταγογράφησης η δυνατότητα στον ιατρό να «κλειδώνει» συγκεκριμένο εμπορικό σκεύασμα.
Σύμφωνα με τον ΠΦΣ, η απαγόρευση των εξαγωγών επιλύει το πρόβλημα, εφόσον, αποδεδειγμένα πλέον, για τα περισσότερα σκευάσματα για τα οποία ισχύει η απαγόρευση εξαγωγής τους, έχει ομαλοποιηθεί σταδιακά η διάθεσή τους στο ελληνικό φαρμακείο. Ωστόσο, εκτιμά, αν αρθεί εκ νέου η απαγόρευση εξαγωγής τους, θα γίνουν και πάλι άμεσα ελλειπτικά. «Για όσα επιτρέπεται η εξαγωγή τους, αυτά έχουν εξαφανιστεί από την ελληνική αγορά αφού υπάρχει τεράστια ζήτηση από τις ευρωπαϊκές χώρες, προκειμένου να καλύψουν τις δικές τους ανάγκες (πχ αντιβιοτικά χάπια και σιρόπια, αναπνευστικά σκευάσματα κλπ)».
Είναι επιβεβλημένο, σημειώνει ο ΠΦΣ, οι φαρμακευτικές εταιρείες, στο πλαίσιο των νομικών δημοσιεύσεων τους, να αυξήσουν τις ποσότητες διάθεσης των φαρμάκων στην ελληνική αγορά και ιδιαίτερα των πρωτότυπων φαρμάκων για τα οποία δεν υπάρχουν γενόσημα.
Όσον αφορά την υποχρέωση των φαρμακαποθηκών να δηλώνουν τις πωλήσεις και τα αποθέματά τους για τα ελλειπτικά φάρμακα, αυτό από μόνο του δεν αρκεί, αναφέρει ο ΠΦΣ, καθόσον απαιτείται σύσταση επιτροπής η οποία να αποτελείται από όλους τους κρίκους της εφοδιαστικής αλυσίδας, προκειμένου να ορίζει ποια είναι τα ελλειπτικά φάρμακα. Φυσικά, προσθέτει, τις πραγματικές ελλείψεις τις γνωρίζουν οι φαρμακοποιοί, μέσω των εκατοντάδων συνταγών οι οποίες αδυνατούν να εκτελεστούν καθημερινά.
Αναφορικά με την υποχρέωση των φαρμακείων να διαθέτουν τα ελλειπτικά σκευάσματα μόνο με την εκτέλεση ηλεκτρονικής συνταγής, είναι κάτι το οποίο οι ίδιοι ζητούσαν και το οποίο εφαρμόζεται ήδη από τις αρχές του έτους.
«Το διαχρονικό πρόβλημα των ελλείψεων, που στη χώρα μας εμφανίζεται ιδιαίτερα οξυμένο, αποτελεί πρόβλημα και των ευρωπαϊκών χωρών, γεγονός που επιδεινώνει την κατάσταση και απαιτεί την αποτελεσματική λειτουργία των μηχανισμών ελέγχου και την πιστή τήρηση των μέτρων που θα πρέπει να ληφθούν από την Πολιτεία», καταλήγει ο ΠΦΣ
Στα πλαίσια του συστήματος φαρμακοεπαγρύπνησης οι Αρμόδιες Αρχές καταχωρούν στην εθνική και ευρωπαϊκή βάση όλες τις εικαζόμενες ανεπιθύμητες ενέργειες που εκδηλώνονται στην Ελληνική Επικράτεια και οι οποίες αναφέρονται αυθόρμητα από ασθενείς ή από επαγγελματίες του τομέα της υγείας στον ΕΟΦ.
Κατηγορίες:
• Ανεπιθύμητη ενέργεια είναι η απόκριση σε ένα φάρμακο που χορηγείται σύμφωνα με τα στοιχεία της άδειας κυκλοφορίας του και είναι επιβλαβής και ακούσια.
• Σοβαρή ανεπιθύμητη ενέργεια είναι η ανεπιθύμητη ενέργεια που θάνατο, είναι άμεσα απειλητική για τη ζωή του ασθενούς, απαιτεί νοσηλεία ή παράταση νοσηλείας, οδηγεί σε μόνιμη ή σημαντική αναπηρία ή ανικανότητα ή επιφέρει συγγενή ανωμαλία/βλάβη κατά τον τοκετό ή αποτελεί σημαντικό ιατρικό συμβάν.
• Μη αναμενόμενη ανεπιθύμητη ενέργεια είναι η ανεπιθύμητη ενέργεια της οποίας η φύση, η σοβαρότητα ή το αποτέλεσμα δεν είναι σύμφωνα με την Περίληψη Χαρακτηριστικών του Προϊόντος.
Ο ΕΟΦ έχει λάβει:
• 9.411 αναφορές πιθανολογούμενων (εικαζόμενων) ανεπιθύμητων ενεργειών ποσοστό 0,055% επί των συνολικών εμβολιασμών με τα εμβόλια έναντι της COVID-19, με τη χρήση της κίτρινης κάρτας, τόσο από επαγγελματίες υγείας, όσο και από πολίτες (5,5 αναφορές /10.000 δόσεις)
Μερικές από τις ανεπιθύμητες παρενέργειες που αναφέρει ο ΕΟΦ είναι οι εξής:
Περιστατικά μυοκαρδίτιδας/ περικαρδίτιδας
Καρδιακές διαταραχές
Αιματολογικές διαταραχές
Αναφορές κατά την εγκυμοσύνη
Αλλεργίες
Νευρολογικά περιστατικά
Διαταραχές έμμηνου ρύσης
Διαταραχές αυτιού/όρασης
Δείτε τη σχετική λίστα ΕΔΩ
Σε απαγόρευση διακίνησης και διάθεσης των βιοκτόνων «ANTY CLEAN» και «Total Care αντισηπτικό τζελ χεριών», προχώρησε ο Εθνικός Οργανισμός Φαρμάκων (ΕΟΦ).
Ο ΕΟΦ ανακαλεί αποστειρωμένη σύριγγα με σκοπό την προάσπιση της Δημόσιας Υγείας.
Ο ΕΟΦ αποφάσισε την ανάκληση της παρτίδας 18069 με ημερομηνία λήξης 10/2023, του ιατροτεχνολογικού προϊόντος Αποστειρωμένη Σύριγγα 20 ml λόγω του ότι το αποτελέσματα του μακροσκοπικού ελέγχου είναι μη κανονικό. Η παρούσα απόφαση αποτελεί προληπτικό μέτρο για την προάσπιση της Δημόσιας Υγείας.
Η εταιρεία M-TEST ΣΠ. ΝΙΚΟΛΑΟΥ & ΣΙΑ ΕΕ, ως διανομέας του προϊόντος στην Ελλάδα, οφείλει να επικοινωνήσει άμεσα με τους αποδέκτες του και να αποσύρει τους συγκεκριμένους κωδικούς από την αγορά.
Τα παραστατικά της ανάκλησης πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Δείτε ΕΔΩ την απόφαση.
Δείτε αναλυτικά ποια σκευάσματα ανακαλούνται - Η ανάκληση είναι εθελοντική και γίνεται προληπτικά μετά την παγκόσμια ανησυχία για την ουσία ρανιτιδίνη που περιέχει τη δυνητικά καρκινογόνο πρόσμιξη NDMA
Στην ανάκληση του φαρμάκου ZANTAC και των γενόσημων, προχωρά ο Ελληνικός Οργανισμός Φαρμάκου.
Συγκεκριμένα, σε ό,τι αφορά στο ZANTAC ανακαλούνται όλες οι παρτίδες του:
ZANTAC EF.TAB 150MG/TAB,
ZANTAC F.C.TAB 150MG/TAB
ZANTAC INJ.SOL 50MG/2ML AMP,
κατόπιν της αναστολής του πιστοποιητικού καταλληλότητας του παραγωγού Saraca Laboratories Limited για τη δραστική ουσία ρανιτιδίνη.
Η ανάκληση είναι εθελοντική και γίνεται προληπτικά εκ μέρους της καθώς και της εταιρείας GLAXOSMITHKLINE AEBE για το σύνολο των προϊόντων ZANTAC, ακόμη και στην περίπτωση παρτίδων από άλλον παραγωγό δραστικής ουσίας (Dr. Reddy’s Limited ).
Η εταιρεία GLAXOSMITHKLINE AEBE ως κάτοχος άδειας κυκλοφορίας των προϊόντων, οφείλει να υλοποιήσει την ανάκληση σε εύλογο χρονικό διάστημα.
Τα παραστατικά της ανάκλησης πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Αναφορικά με το προϊόν RANITIDINE της MYLAN, ανακαλούνται τα ακόλουθα:
RANTIDINE/MYLAN 150MG F.C. TAB K110115A 9/2019
RANTIDINE/MYLAN 150MG F.C. TAB K110116A 3/2019
RANTIDINE/MYLAN 150MG F.C. TAB K110216A 5/2019
Σύμφωνα με σχετική ανακοίνωση του ΕΟΦ, η απόφαση αποτελεί «προληπτικό μέτρο για την προάσπιση της Δημόσιας Υγείας με σκοπό να ενισχύσει την εθελοντική ανάκληση στην οποία προβαίνει η εταιρεία, κατόπιν της αναστολής του πιστοποιητικού καταλληλότητας του παραγωγού Saraca Laboratories Limited για τη δραστική ουσία ρανιτιδίνη».
Η εταιρεία GENERICS PHARMA HELLAS ΕΠΕ ως τοπικός αντιπρόσωπος των προϊόντων, οφείλει να υλοποιήσει την ανάκληση σε εύλογο χρονικό διάστημα. Τα παραστατικά της ανάκλησης πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Ο ΕΟΦ αποφασίζει την ανάκληση των παρτίδων, 1803 (ημ. ληξ.: 12-2020) του καλλυντικού προϊόντος «Γαλαξίας, μάνγκο, Κρεμοσάπουνο» και 1804 (ημ. ληξ.: 03-2021) του καλλυντικού προϊόντος «Γαλαξίας, μέλι & γάλα, Κρεμοσάπουνο». Στις ανακαλούμενες παρτίδες, μετά από εργαστηριακό έλεγχο, διαπιστώθηκε ότι ο συνολικός αριθμός των αερόβιων μεσόφιλων μικροοργανισμών ήταν εκτός ορίων ενώ παράλληλα ταυτοποιήθηκε το βακτηρίδιο “Pseudomonas putida”. Ως εκ τούτου τα αποτελέσματα δεν συμφωνούν με τις προδιαγραφές των προϊόντων.
Η παρούσα απόφαση εκδίδεται στα πλαίσια της προστασίας της Δημοσιάς Υγείας. Η εταιρεία ΖΥΓΟΣ ΕΛΛΑΣ η οποία έχει πραγματοποιήσει τη διάθεση των παρτίδων των προϊόντων στην Ελληνική Αγορά οφείλει να επικοινωνήσει άμεσα με τους αποδέκτες του προϊόντος προκειμένου να τις αποσύρει.
Τα σχετικά παραστατικά πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Δείτε την απόφαση εδώ.
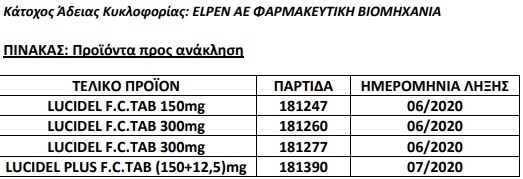
ΕΟΦ: Την ανάκληση συγκεκριμένων παρτίδων (βλ. συνημμένο Πίνακα) των φαρμακευτικών προϊόντων LUCIDEL 150 mg, LUCIDEL 300 mg και LUCIDEL PLUS (150+12,5) mg.
Η παρούσα απόφαση αποτελεί προληπτικό μέτρο για την προάσπιση της Δημόσιας Υγείας με σκοπό να ενισχύσει την εθελοντική ανάκληση στην οποία προβαίνει η εταιρεία ELPEN, κατόπιν ανίχνευσης στη δραστική ουσία ιρβεσαρτάνη της ουσίας NDEA (πιθανός καρκινογόνος παράγοντας) σε επίπεδα άνω των επιτρεπτών ορίων.
Η εταιρεία ELPEN ως κάτοχος άδειας κυκλοφορίας των προϊόντων, οφείλει να υλοποιήσει την ανάκληση σε εύλογο χρονικό διάστημα. Τα παραστατικά της ανάκλησης πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Το Lucidel ενδείκνυται για χρήση σε ενήλικες για τη θεραπεία της ιδιοπαθούς υπέρτασης. Ενδείκνυται επίσης για τη θεραπεία της νεφροπάθειας σε ενήλικες ασθενείς με αρτηριακή υπέρταση και σακχαρώδη διαβήτη.